Biomédicaments : les enjeux du passage à la production en Île-de-France
De nombreux biomédicaments sont aujourd’hui développés en Île-de-France. Les assises régionales des biothérapies de 2021 ont mis en lumière la richesse de l’écosystème francilien tout en préconisant sa meilleure structuration. Les actions déjà engagées par la région sont à poursuivre pour étoffer et diversifier l’écosystème « biothérapies/bioproduction », résorber les difficultés dans la chaîne de valeur, et doter le territoire francilien d’une offre immobilière adaptée et compétitive. Il s’agit de rassembler les conditions pour donner aux start-up et PME franciliennes les moyens de se développer en Île-de-France, et ainsi renforcer cet écosystème stratégique, indispensable à toute métropole mondiale.
Les « biomédicaments », ou médicaments biologiques, regroupent diverses classes de médicaments (protéines, ADN, ARN, thérapies géniques ou cellulaires, anticorps et ADC…) ayant pour point commun de faire appel à une source biologique comme matière première du principe actif qu’ils renferment. Ils offrent de nouvelles solutions thérapeutiques pour des pathologies jusqu’alors incurables et sont particulièrement prometteurs dans le traitement des cancers. Certaines biothérapies sont déjà commercialisées, et beaucoup d’autres sont en passe de l’être. Dans toutes les grandes régions urbaines d’Amérique du Nord, d’Asie et d’Europe, les recherches progressent au sein de bioclusters, qui se renforcent. Mais les biomédicaments sont aujourd’hui extrêmement coûteux. Afin de préserver la soutenabilité du système de financement de la santé, de ne pas alourdir le déficit de la balance commerciale, et de garantir une souveraineté technologique et sanitaire, la France s’est fixé l’objectif de produire sur son territoire 20 nouvelles biothérapies d’ici 2030. Pour avancer dans l’élaboration d’un biomédicament, bien avant d’arriver au stade de la commercialisation (dans une minorité de cas), les start-up ont besoin de disposer de la thérapie prometteuse dans de petites quantités. Celles-ci sont utilisées pour le développement en laboratoire (on parle de « lots non GMP »), puis, si l’intérêt thérapeutique se confirme, pour les différentes phases d’essais cliniques (« lots cliniques » ou « lots GMP »). Dans le cas des biothérapies, la production de ces lots nécessite des équipements coûteux et des compétences dont les start-up ne disposent généralement pas. Elles s’adressent donc quasi systématiquement à des CDMO (Contract Development and Manufacturing Organizations), ces sociétés privées étant des façonniers sous-traitants qui produisent pour des tiers.
POUR LES PME, DES TENSIONS SUR L’ACCÈS À TOUTES LES GAMMES DE LOTS
Les start-up franciliennes sont confrontées à quatre écueils majeurs, et en premier lieu au manque de CDMO : la plupart des start-up franciliennes ne trouvent en Île-de-France, ni même en France, celles dont elles ont besoin, et se tournent vers des entreprises en Italie, en Belgique, en Suisse ou aux États-Unis. Deuxièmement, la difficulté des relations entre CDMO et start-up, ces dernières souffrant de rapports qui semblent globalement déséquilibrés. Les CDMO leur préfèrent des entreprises pharmaceutiques plus matures : les petites structures, en particulier dans ce contexte de rareté des sous-traitants, pâtissent ainsi de la concurrence des gros clients pour accéder aux lignes de production. Troisièmement, les start-up attendent des CDMO qu’elles soient plus ouvertes à l’accueil de leurs équipes, car – et c’est une spécificité de ces nouvelles thérapies – l’innovation concerne autant le biomédicament que son processus de fabrication. La maîtrise de la fabrication, d’une grande complexité, est essentielle à la bonne marche du développement de la biothérapie. Enfin, dernier écueil, nombre de ces start-up cherchent des CDMO en capacité de produire toutes les gammes de lots, depuis les lots pré-cliniques jusqu’aux lots commerciaux. Les structures produisant à toutes ces échelles sont encore plus rares. Yposkesi, située au sein du biocluster Genopole, à Évry, en est une. Issue des recherches financées par le Généthon, et rachetée en 2021 par l’entreprise américano-coréenne SK, elle repositionne actuellement son offre. Les difficultés des petites entreprises pour travailler avec des CDMO qui répondent à leurs attentes sont prises très au sérieux par les pouvoirs publics, car là où sont produits les lots cliniques sont également produits les lots commerciaux, qui génèrent des retombées économiques sur les territoires. Des réflexions sont en cours afin de faire émerger en Île-de-France une plateforme mutualisée entre start-up, qui garderaient ainsi la maîtrise du process de production de leurs lots. De manière générale, doter l’Île-de-France ou le Bassin parisien de nouvelles CDMO aptes à produire à toutes les échelles et ouvertes aux problématiques spécifiques des petites entreprises est un objectif pour développer une filière « bioproduction ».
UNE LOGIQUE DE PROXIMITÉ GÉOGRAPHIQUE ENTRE CENTRES PRODUCTEURS DE LOTS CLINIQUES ET USINES
Les rapprochements entre centres d’innovation produisant des lots cliniques et usines produisant les biomédicaments commercialisés sont une réalité, actuellement mise en œuvre, par exemple, par Merck, à Vevey, en Suisse, avec la construction de son Biotech Development Center (opérationnel courant 2023), à proximité immédiate de ses sites industriels. Dans une stratégie d’anticipation, le géant pharmaceutique américain élabore aujourd’hui plusieurs biomédicaments qui seront produits dans son usine demain. Cette approche, valable pour une grande entreprise pharmaceutique, l’est également pour les CDMO produisant pour des tiers, et pour les territoires. C’est, notamment, ce que vise Genopole quand ce biocluster cherche à pérenniser l’implantation des entreprises de bioproduction nées dans ses laboratoires. Mais les difficultés ne se situent pas uniquement au niveau de la production des médicaments en développement. À différentes étapes de la chaîne de valeur, et selon le domaine (thérapie génique, vaccin, etc.), les obstacles à lever sont encore nombreux.
UN MANQUE DE PRODUCTEURS DE PLASMIDES, POUR LES START-UP DE LA THÉRAPIE GÉNIQUE
Les thérapies géniques nécessitent l’usage de « vecteurs » pour transporter le matériel génétique thérapeutique dans les cellules d’un patient. Les plasmides constituent un type de vecteurs. Ce produit paraissait peu stratégique, peu créateur de valeur. Alors qu’un nombre réduit d’entreprises produisent des plasmides, la demande en ARN messager, qui nécessite également ces vecteurs, est venue concurrencer la demande des entreprises de thérapies géniques sur les chaînes de production. Cette situation s’est, de surcroît, accompagnée d’une hausse des prix. La forte décélération de l'épidémie devrait améliorer la situation, mais cela n'est pas assuré.
UN RISQUE DE DÉPENDANCE CRITIQUE VIS-À-VIS DE LA CHINE, POUR LES START-UP DU VACCIN
Plusieurs start-up franciliennes mettent au point des vaccins. Les réglementations en vigueur en Europe imposent de passer par des expérimentations animales, sur des singes. Or, l’accès aux animaleries où l’on réalise ces tests est devenu très compliqué pour les petites structures : les prix ont été multipliés par trois et les délais allongés de six à douze mois. Ce problème se pose à l’échelle européenne, voire mondiale, même si la Chine et les États-Unis y sont moins exposés, car ces deux pays peuvent compter sur leurs propres fermes de singes et disposent de réglementations différentes. En l’état actuel de la réglementation, la situation a l’inconvénient grave d’obliger les Européens à faire leurs études en Chine, ce qui crée une dépendance critique vis-à-vis de cet État.
DES TENSIONS SUR LE MATÉRIEL DE LABORATOIRE ET LES COMPOSANTS ÉLECTRONIQUES
Les entreprises continuent à rencontrer des difficultés pour acquérir, au moment voulu, nombre de produits de base nécessaires aux travaux de laboratoire, en particulier des filtres et des milieux de culture. La situation est telle que les CDMO demandent à leurs clients de payer de façon très anticipée ces produits coûteux, afin de les commander plusieurs mois en avance pour les stocker sur le site et les avoir à disposition le moment venu. Ces produits sont exportés des États-Unis ou d’Allemagne. D’après Merck, fournisseur majeur en Europe, les difficultés pour satisfaire la forte hausse de la demande sont théoriquement réglées en ce qui concerne les milieux de culture. Pour les filtres, elles sont en passe de l’être, notamment grâce à ses investissements réalisés en 2022 en Allemagne et ceux annoncés à l’horizon 2024 pour son site de Cork, en Irlande, afin de satisfaire l’ensemble de la demande européenne. À partir de 2024, l’industriel estime qu’il ne devrait plus y avoir de difficultés d’approvisionnement. Concernant les cuves de bioréacteurs, il précise qu’il n’a pas de problème pour satisfaire la demande et n’en anticipe pas, tant qu’elle n’est pas décuplée. Merck alerte cependant sur une tension potentielle liée aux difficultés d’approvisionnement en composants électroniques, pour lesquels ses besoins pourraient se retrouver en concurrence avec ceux d’autres filières industrielles, en particulier l’industrie automobile.
LA PROFESSIONNALISATION DES ESSAIS CLINIQUES EN QUESTION
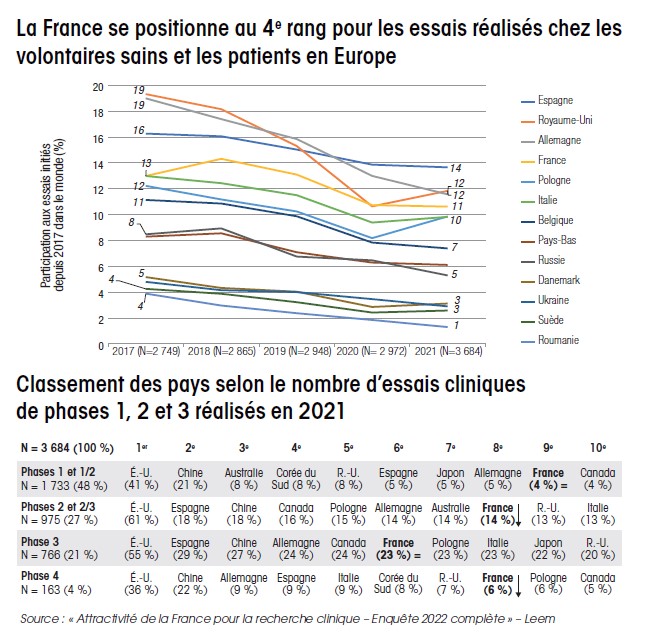
Selon les témoignages recueillis, les essais cliniques sont parfois réalisés dans des situations compliquées pour les équipes des hôpitaux de l’Assistance publique-Hôpitaux de Paris (AP-HP), tensions que ressentent les start-up. L’une des raisons avancées est que les médecins hospitaliers, confrontés à une charge de travail colossale, disposent d’un nombre très insuffisant d’assistants de recherche pour réaliser parfaitement ce type de travaux. Ce constat s’inscrit dans une tendance au recul de l’attractivité de la France dans la compétition mondiale aux essais cliniques industriels, qui, bien que stabilisée, ne se redresse pas. En 2022, d’après une étude du Leem, l’organisation professionnelle des entreprises du médicament en France, l’Hexagone se retrouvait derrière la Chine, les États-Unis, l’Espagne (désormais leader européen), l’Allemagne et la Grande-Bretagne, et, dans plusieurs cas, également derrière la Corée du Sud, l’Australie et le Canada (voir graphiques p. 5)5. Si d’autres leviers existent, de l’avis de nombreux professionnels, il est stratégique d’améliorer la professionnalisation des essais cliniques.
RATTRAPAGE EN COURS POUR DOTER LA RÉGION D’UNE OFFRE IMMOBILIÈRE ADAPTÉE ET COMPÉTITIVE
Le manque de laboratoires L1 et L2 (c’est-à-dire « standards » ou « confinés de niveau 2 » sur une échelle de 1 à 4) est systématiquement mentionné. Plusieurs entreprises restent dans des locaux exigus, avec des bureaux distants des paillasses, par manque de surfaces disponibles dans les locaux intégrant les laboratoires. Bien que le Conseil régional d’Île-de-France en ait financé plusieurs, les locaux avec animalerie intégrée demeurent rares, ce qui impose des conditions de travail difficiles aux équipes. Les professionnels déplorent que les incubateurs et pépinières situés à Paris ou en petite couronne soient pleins. À quoi bon permettre l’émergence de start-up puis de PME prometteuses si le parcours résidentiel de celles qui désirent rester dans la région n’est pas mieux assuré ? Après d’autres régions d’Europe, l’Île-de-France est devenue très attractive pour les investisseurs étrangers spécialisés dans l’immobilier life science, combinant bureaux et laboratoires avec différents niveaux de confinement nécessaires aux entreprises technologiques des sciences de la vie. Plusieurs projets sortent ou sortiront d’ici 2024-2025. Les tensions sur ce type de locaux mettront donc quelques années à se résorber, mais cela semble en bonne voie. Il importe toutefois de rester vigilant sur la satisfaction effective de la demande dans la durée, pour les dix ou vingt prochaines années. La réalisation d’un chiffrage prospectif des besoins des entreprises mis en regard avec les surfaces disponibles à différentes échéances est un exercice complexe. Il est en cours, sous la responsabilité du pôle de compétitivité Medicen. Cet enjeu immobilier est clé, car, à quelques heures de TGV, d’autres métropoles mettent en œuvre des stratégies d’attractivité, en particulier en Suisse : le Grand Genève (Greater Geneva Bern Area-GGBA) ; Bâle, qui communique activement sur la montée en puissance des thérapies géniques et cellulaires dans sa région ; Lausanne et son Biopôle… Leurs stratégies ne s’appuient pas seulement sur des dispositifs fiscaux très avantageux, elles vantent également, auprès des start-up franciliennes, les mérites d’un environnement de travail de qualité : des laboratoires de tous types, et des locaux vastes et équipés, dans un cluster de biotechs.
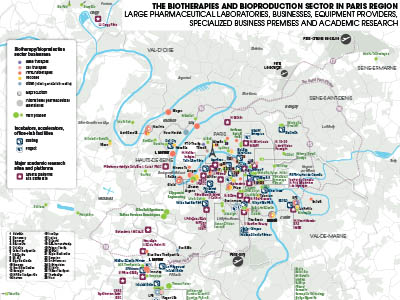
UNE GRANDE VARIÉTÉ DE SITES FRANCILIENS
Si les structures existantes ou en projet situées à Paris ou en petite couronne sont plébiscitées, elles ne sont jamais exclusivement réservées au développement de la bioproduction. Biolabs Hôtel-Dieu, à Paris, par exemple, est dédié plus largement aux biotechnologies et à la santé numérique. Adossé à l’hôpital Gustave-Roussy de Villejuif, le Paris Saclay Cancer Cluster (PSCC) accueillera, à terme, sur 100 000 m², tout le spectre de la R&D appliquée à l’oncologie, biothérapies comprises. Quant à Biocitech, à Romainville – desservi par le métro –, la question serait de savoir s’il y aurait un intérêt régional à orienter ce site racheté par les investisseurs immobiliers Oxford et Novaxia – 21 000 m² d’immobilier à rénover et 3,5 ha de potentiel foncier contigu – vers la R&D de la bioproduction, la très proche couronne pouvant constituer un atout géographique dans une filière où le recrutement demeure un sujet de préoccupation. Le maintien de ce site dans le giron de l’industrie (il appartenait à Sanofi) serait par ailleurs un bel exemple de mise en œuvre de la notion de « ville productive ». En grande couronne, l’Essonne accueille plusieurs sites. Un grand nombre de laboratoires et d’entreprises issus de Genopole, à Évry, sont engagés dans des projets de recherche majeurs et continuent de se développer dans le biocluster. Yposkesi, par exemple, l’une des rares entreprises de bioproduction présentes sur le sol francilien, construit une deuxième usine, lui permettant ainsi de doubler sa production de vecteurs viraux. Le démarrage de la production commerciale est prévu en 2024. L’entreprise pourra en outre étendre encore ses capacités de production si nécessaire. Par ailleurs, Genopole se dote d’un bâtiment de sept étages, GenopoleNext, pour permettre aux start-up nées à Genopole et devenues des PME d’y poursuivre leur parcours résidentiel. La livraison des 21 000 m² de laboratoires et bureaux est prévue en 2025. Parallèlement, la pépinière existante va être rénovée. Quant à l’étape industrielle, son développement est prévu par la communauté d’agglomération Grand Paris Sud dans le quartier du Bois Sauvage, au nord de Genopole, avec 5 ha dédiés à la bioproduction à partir de 2026. C’est donc l’ensemble des besoins immobiliers des entreprises qui est ainsi repensé, rénové et étendu. Le parc d’activités de Courtaboeuf, aux Ulis, axé sur l’accueil d’entreprises technologiques, notamment dans le domaine pharmaceutique, est de ce fait un site d’activités reconnu des entreprises de l’écosystème, qui apprécient les efforts réalisés pour améliorer sa desserte. Le plateau de Saclay, qui accueille déjà des start-up de cet écosystème, pourrait voir son rôle renforcé. D’ores et déjà, l’incubateur SPartners Servier-Biolabs, ouvert en juin, accueille sa première entreprise de biothérapies, AGS Therapeutics ; et à proximité, le promoteur-investisseur Kadans proposera 14 000 m² de surfaces life science disponibles en 2026, permettant une modulation des surfaces entre bureaux et laboratoires sur 80 % de sa surface. À Chilly-Mazarin, la fermeture du site de Sanofi offrira, peut-être, des opportunités à l’essor de la bioproduction francilienne. Le développement de l’industrie des biomédicaments est une activité complexe et risquée, mais toutes les métropoles investissent dans ce domaine. L’écosystème francilien des biothérapies est particulièrement riche en start-up et PME. En plus des efforts consacrés en amont en matière de R&D et d’innovation, il est essentiel de les accompagner dans leur capacité à se développer en Île-de- France, notamment pour les activités productives, afin que les retombées économiques bénéficient aux territoires qui ont œuvré à leur croissance. Les efforts pour combler les manques dans les chaînes de valeur et installer des sites de bioproduction devront être soutenus, a fortiori dans un contexte où les États-Unis se sont dotés de plusieurs textes visant à relocaliser en Amérique du Nord les chaines de production de secteurs stratégiques dont celui de la bioéconomie.■
Cette étude est reliée aux catégories suivantes :
Industries et services |
Innovation et clusters